
 Il microscopio a forza atomica (AFM) fa parte della famiglia dei microscopi a scansione di sonda ed è ampiamente utilizzato per applicazioni biologiche. L’AFM utilizza un cantilever flessibile, portato a contatto con il campione e spostato sulla superficie. Misurando la deflessione del cantilever causata da forze locali attrattive o repulsive, l’AFM fornisce un’immagine tridimensionale che riflette diverse proprietà del campione, oltre ad una sua analisi topografica. Nello specifico, NanoWizard® 4 XP NanoScience AFM consente una scansione rapida in ampie aree con risoluzione atomica. Un’ampia gamma di modalità e accessori per la mappatura delle proprietà nanomeccaniche, elettriche, magnetiche o termiche consentono diverse analisi su cellule viventi nonché studi su singole molecole in soluzioni tampone, a temperatura controllata sfruttando la presenza di una specifica cella termostatata. Inoltre, il sistema FluidFM consente di erogare fluidi attraverso il cantilever con risoluzione del femtolitro estendendo così l’ambito dell’applicazione oltre l’imaging e la spettroscopia di forza. Ad esempio, utilizzando il cantilever per stimolare una cellula, è possibile studiarne la sua risposta viscoelastica. Si possono osservare le variazioni delle proprietà meccaniche durante la divisione cellulare o in seguito all’aggiunta di farmaci che distruggono il citoscheletro. È possibile allungare o dispiegare singole molecole e analizzarne le proprietà di adesione, oppure studiare molecole in azione (ad esempio enzimi che digeriscono il loro substrato). Infine, il modulo Scanning Thermal Microscopy (SThM) consente di determinare le proprietà termiche locali di un materiale fornendo immagini termiche ad alta risoluzione (< 0,1 ˚C) su scala nanometrica.
Il microscopio a forza atomica (AFM) fa parte della famiglia dei microscopi a scansione di sonda ed è ampiamente utilizzato per applicazioni biologiche. L’AFM utilizza un cantilever flessibile, portato a contatto con il campione e spostato sulla superficie. Misurando la deflessione del cantilever causata da forze locali attrattive o repulsive, l’AFM fornisce un’immagine tridimensionale che riflette diverse proprietà del campione, oltre ad una sua analisi topografica. Nello specifico, NanoWizard® 4 XP NanoScience AFM consente una scansione rapida in ampie aree con risoluzione atomica. Un’ampia gamma di modalità e accessori per la mappatura delle proprietà nanomeccaniche, elettriche, magnetiche o termiche consentono diverse analisi su cellule viventi nonché studi su singole molecole in soluzioni tampone, a temperatura controllata sfruttando la presenza di una specifica cella termostatata. Inoltre, il sistema FluidFM consente di erogare fluidi attraverso il cantilever con risoluzione del femtolitro estendendo così l’ambito dell’applicazione oltre l’imaging e la spettroscopia di forza. Ad esempio, utilizzando il cantilever per stimolare una cellula, è possibile studiarne la sua risposta viscoelastica. Si possono osservare le variazioni delle proprietà meccaniche durante la divisione cellulare o in seguito all’aggiunta di farmaci che distruggono il citoscheletro. È possibile allungare o dispiegare singole molecole e analizzarne le proprietà di adesione, oppure studiare molecole in azione (ad esempio enzimi che digeriscono il loro substrato). Infine, il modulo Scanning Thermal Microscopy (SThM) consente di determinare le proprietà termiche locali di un materiale fornendo immagini termiche ad alta risoluzione (< 0,1 ˚C) su scala nanometrica.
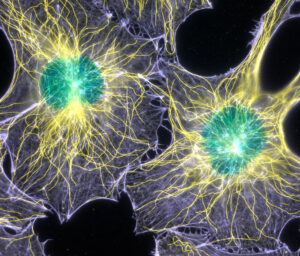
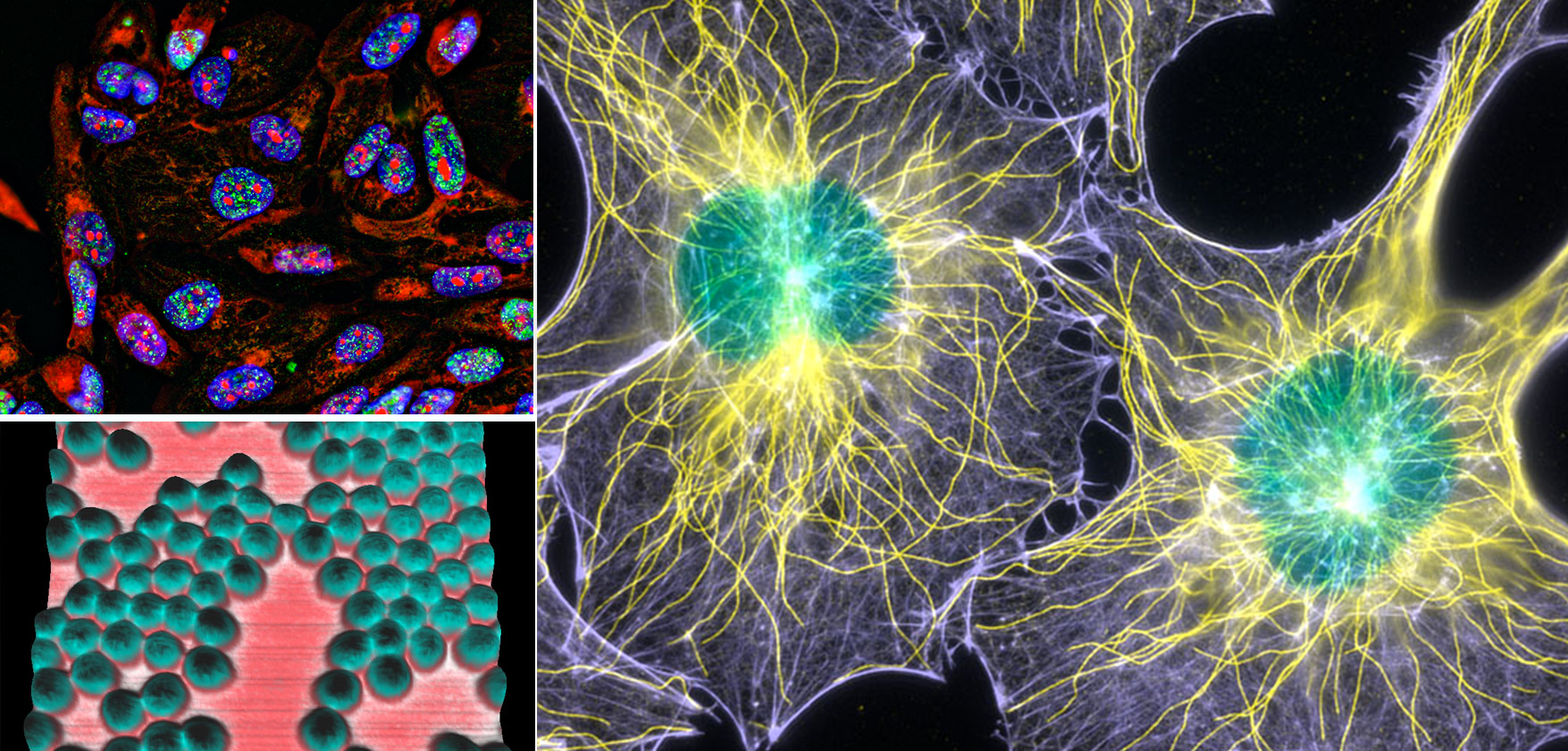
 Il microscopio confocale permette di effettuare acquisizioni simultanee di più fluorofori nel range di lunghezze d’onda 405-790nm. I detector di cui dispone la macchina sono di tipo Hybrid: questi permettono un accurato conteggio di fotoni, rendendo più affidabile la quantificazione dei segnali fluorescenti, e un’elevata sensibilità. È perciò possibile ridurre la potenza del laser, riducendo fenomeni di photobleaching ed il conseguente danneggiamento del campione. Inoltre, il tavolino traslatore X/Y motorizzato ultrapreciso permette l’acquisizione di campioni di grandi dimensioni. È infine possibile effettuare misure di FRET e FRAP, nonché misure in time-lapse su campioni biologici non fissati, grazie alla presenza di un incubatore a Temperatura e CO2 controllata.
Il microscopio confocale permette di effettuare acquisizioni simultanee di più fluorofori nel range di lunghezze d’onda 405-790nm. I detector di cui dispone la macchina sono di tipo Hybrid: questi permettono un accurato conteggio di fotoni, rendendo più affidabile la quantificazione dei segnali fluorescenti, e un’elevata sensibilità. È perciò possibile ridurre la potenza del laser, riducendo fenomeni di photobleaching ed il conseguente danneggiamento del campione. Inoltre, il tavolino traslatore X/Y motorizzato ultrapreciso permette l’acquisizione di campioni di grandi dimensioni. È infine possibile effettuare misure di FRET e FRAP, nonché misure in time-lapse su campioni biologici non fissati, grazie alla presenza di un incubatore a Temperatura e CO2 controllata.